L’auteur, cancérologue à Marseille signale l’augmentation récente de ces cancers chez les moins de 50 ans. La cause semble liée à l’exposome. Le microbiote joue ici un rôle essentiel. Il propose de ne pas céder à la panique, éviter les simplifications abusives, soutenir notre système de santé, mettre en place des mesures fortes pour agir sur les facteurs de risque déjà identifiés et développer de grands programmes nationaux et européens de recherche multiparamétrique
Abstract : The author, an oncologist in Marseille, reports a recent increase in these cancers among those under 50. The cause appears to be linked to the exposome. The microbiota plays a crucial role here. He suggests not giving in to panic, avoiding oversimplification, supporting our healthcare system, implementing strong measures to address already identified risk factors, and developing large-scale national and European multiparametric research programs.
Devenue récemment une réalité épidémiologique incontestable dans plusieurs pays occidentaux, l’augmentation du nombre des cancers digestifs survenant avant l’âge de 50 ans intrigue et est au cœur d’un nombre grandissant de recherches multiformes. Modes de vie et expositions environnementales sont parmi les suspects numéro 1.
Données épidémiologiques
Les cancers sont une des causes les plus importantes de morbidité et de mortalité. En 2020, les statistiques mondiales identifiaient les cancers du sein, du poumon et colorectaux comme les plus fréquents ; les cancers du poumon étant la première cause de mortalité, suivi par le côlon et le sein. Le nombre de nouveaux cancers de survenue précoce – c’est-à-dire survenant chez des adultes de moins de 50 ans – a augmenté dans un grand nombre de pays au cours des trente dernières années. C’est particulièrement vrai pour les cancers du tractus digestif, et notamment les cancers colorectaux (CCR).
Une étude de Santé publique France (projet EPI-AJA 2022)1 a analysé la distribution, l’incidence et l’évolution sur la période 2000-2020 des cancers chez les adolescents et jeunes adultes, âgés de 15 à 39 ans, dans les départements couverts par un registre général des cancers en France hexagonale. Il est observé une augmentation annuelle de 2,62 % des cancers digestifs, dont 1,43 % pour les CCR. Une étude nord-américaine a montré que, par rapport aux personnes nées entre 1955 et 1959, le taux de CCR de survenue précoce est 1,3 fois plus élevé pour celles nées entre 1970 et 1974, et 2,62 fois plus élevé pour celles nées entre 1990 et 1994. Cet effet « cohorte de naissance » est connu dans les phénomènes de santé publique comme un reflet possible de modifications d’exposition à des facteurs de risque, notamment dans les premières années de vie.
Quels sont les suspects ?
Les données épidémiologiques indiquent que ces cancers précoces ne peuvent pas être pleinement expliqués par une augmentation d’expression de caractères héréditaires de prédisposition aux cancers. Ils sont plus probablement la conséquence d’expositions environnementales, ce qu’on appelle l’exposome, défini par l’impact cumulatif des expositions environnementales et les réponses biologiques qui leur sont associées tout au long de la vie, et en interaction complexe et permanente avec le génome des individus2. L’augmentation de l’incidence des cancers de survenue précoce pourrait donc résulter de diverses modifications d’exposition, notamment dans les premières années de vie.
Parmi les responsables suspectés figurent surtout les modifications du mode de vie, les changements dans la composition des aliments, mais aussi la distribution ou l’abondance de micro-organismes (virus, bactéries, champignons) favorables au cancer et, de façon plus hypothétique, les pesticides, les polluants et autres produits chimiques environnementaux, des additifs alimentaires, des médicaments ou des modifications de leur utilisation ou encore le changement climatique3. Il est à signaler que les niveaux de preuves permettant d’impliquer tel ou tel facteur sont très inégaux.
C’est dans le domaine des CCR que les études visant à identifier des mécanismes explicatifs sont les plus nombreuses, avec plusieurs observations d’intérêt. Alors que la mortalité par CCR continue globalement de diminuer, des tendances spécifiques sont notés chez les moins de 50 ans :
– ils représentent 20 % des diagnostics de CCR (contre 11 % en 1995). Les stades au moment du diagnostic sont plus avancés, et les tumeurs au côlon gauche sont en augmentation par rapport au côlon droit (avec des différences moléculaires et probablement étiologiques4) ;
– les CCR précoces sont plus fréquents, et leur mortalité est plus élevée chez les hommes que chez les femmes ;
– l’impact de comorbidités métaboliques. L’obésité, le diabète de type II (acquis), les dyslipidémies (élévation du cholestérol ou des triglycérides) et le syndrome métabolique ont été associés à un risque plus élevé de CCR de survenue précoce.
– le rôle des modes de vie et les facteurs de risque diététiques. L’alcool, le tabac, la sédentarité, l’inactivité physique ont été retrouvés comme facteurs de risque associés à des CCR précoces par de nombreuses études, bien que de façon inconstante5. Le régime dit « occidental » (céréales raffinées pauvres en fibres, produits laitiers riches en matières grasses, viandes rouges et nourriture ultra-transformée, boissons sucrées), riche en procarcinogènes, est également fortement suspecté, alors que les consommations de poissons, β-carotène, vitamine C, folates, vitamine E, fruits et légumes joueraient un rôle protecteur. Pour le Centre international de recherche sur le cancer, basé à Lyon, la consommation de viande rouge est considérée comme probablement cancérogène pour l’homme (CCR et cancer du pancréas notamment), tandis qu’il considère comme certainement cancérogène pour l’homme la consommation de viandes transformées. Il est probable que cet effet soit induit par la production de substances chimiques cancérogènes.
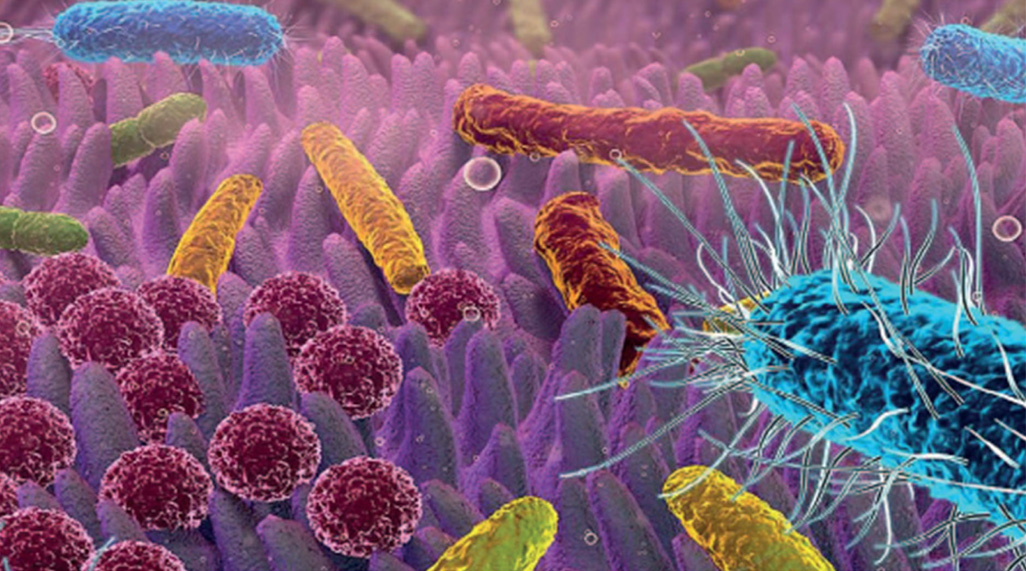
L’importance du microbiote
Un grand nombre de données tendent à confirmer un lien entre le microbiote (défini comme la collection des bactéries, virus, champignons, parasites… qui peuplent le corps humain, et tout particulièrement le tractus digestif) et les CCR6. Le microbiote est lui-même sous l’influence de l’alimentation, et peut donc faire le lien entre environnement extérieur et cancer digestif. Il faut noter que le rôle carcinogène de certaines bactéries est particulièrement bien décrit dans les cancers gastriques. Plusieurs bactéries intestinales peuvent interagir fortement avec le système immunitaire et perturber sa réponse à la croissance tumorale. Le microbiote digestif peut également générer une grande variété de métabolites qui peuvent se révéler génoprotecteurs ou, au contraire, génotoxique et impacter la croissance tumorale. Ainsi, des modifications de la diversité du microbiote bactérien ont pu être associées au CCR et la prédominance de certaines bactéries a pu être corrélée aux formes précoces. Ces perturbations microbiologiques peuvent donc induire un déséquilibre au sein du microbiote intestinal (dysbiose), favorable au développement de cancers précoces.
Bien que fortement interrogées et médiatiquement exposées, les données sur la place des pesticides et des pollutions environnementales restent parcellaires et très indirectes, souvent par défaut de données disponibles ou de qualité insuffisante. S’il existe un lien avéré entre l’exposition professionnelle des agriculteurs à certains pesticides et certains cancers, les cancers digestifs ne semblent pas concernés. Une étude récente a suggéré une corrélation géographique entre l’incidence des cancers pancréatiques et l’exposition aux pesticides ; cependant, cette étude n’établit aucun lien de causalité, et l’amplitude du lien mis en évidence est très faible7. De plus, les agriculteurs constituent une catégorie socioprofessionnelle au sein de laquelle l’incidence des cancers du pancréas est la plus faible, et il n’y a pas de données liant ces expositions à l’âge jeune des patients.
L’ingestion de microplastiques a pu également être suspectée dans l’augmentation des CCR précoces, via des lésions de la muqueuse et les modifications du microbiote induites, mais les données factuelles restent encore à produire. Plus récemment, le rôle du cadmium (cancérogène certain, présent notamment dans les engrais phosphatés, et donc potentiellement dans les cultures céréalières, mais aussi et surtout associé au tabagisme) a été suggéré comme possiblement associé à l’augmentation des cancers pancréatiques. Les données pour ce type de cancer, également lié au tabac, et encore plus chez les jeunes, restent cependant fragiles.
Que faire ?
Compte tenu du nombre important des suspects potentiels dans les modifications de l’exposome, de nouvelles approches d’analyse sont nécessaires, au-delà du trop simple « une exposition, une maladie ». Des études longitudinales démarrant dans l’enfance, et même pendant la grossesse (dans la vie intra-utérine donc), paraissent nécessaires. Les spécimens biologiques collectés pour d’autres raisons dans cette période sont alors de grande valeur, tout comme les échantillons obtenus chez les patients atteints de cancers précoces (tissu tumoral, sang, selles).
Face à ce phénomène, nous devons donc réagir sur plusieurs fronts.
D’abord ne pas céder à la panique : les modifications épidémiologiques décrites sont réelles et significatives mais on reste bien loin de l’« épidémie » ou des « tsunami » et autres métaphores médiatiques souvent utilisées. Les cancers, y compris digestifs, restent très majoritairement des maladies des sujets âgés.
Éviter les simplifications abusives : le terme « pesticide » ou « polluant » ne veut pas dire grand-chose (lequel et à quelle dose ?) et le caractère chimique d’un produit ne garantit pas sa toxicité à coup sûr (comme le côté « naturel » ou « bio », d’ailleurs, ne garantit pas l’innocuité). L’implication de tel ou tel composé doit être analysée sans a priori et de façon rigoureuse, car si elle est confirmée, elle peut impliquer des régulations dont les conséquences sont parfois majeures pour la société. La place des agences indépendantes et des laboratoires académiques dans ces évaluations doit être prépondérante, plutôt que le discours unique des industriels. Même lorsque les signaux sont faibles, ils doivent être pris au sérieux car le concept d’exposome suggère que la multiplication des expositions même à faible risque peut se potentialiser. Sur ces deux points, le vote récent de loi Duplomb constitue une régression inquiétante. La place des agences indépendantes et des laboratoires académiques dans ces évaluations doit être prépondérante, plutôt que le discours unique des industriels. Même lorsque les signaux sont faibles, ils doivent être pris au sérieux car le concept d’exposome suggère que la multiplication des expositions même à faible risque peut se potentialiser. Sur ces deux points, le vote récent de loi Duplomb constitue une régression inquiétante.
Soutenir notre système de santé pour faire face à cette fréquence plus élevée de patients jeunes et dont la prise en charge pose des problèmes spécifiques, incluant l’accès aux soins, mais aussi l’après-cancer avec la gestion des séquelles thérapeutiques (chirurgie, radiothérapie et chimiothérapie, avec les modifications de l’image corporelle, les stomies, les douleurs, les troubles urinaires, digestifs et sexuels ou la neuropathie chimio-induite), l’impact psychosocial et économique, la réhabilitation et la réinsertion. Il faut également interroger la possibilité de faire évoluer les approches de dépistage systématique des CCR pour des âges plus précoces.
En parallèle, mettre en place des mesures fortes pour agir sur les facteurs de risque déjà identifiés, et ce dès la prime enfance : promotion de la consommation de céréales complètes, laitages pauvres en matières grasses, fruits et légumes, réduction de la consommation de sucres, d’additifs alimentaires, de produits ultratransformés et de viande rouge, activité physique, lutte contre le tabagisme, l’obésité et l’alcoolisme.
Développer de grands programmes nationaux et européens de recherche multiparamétrique basée sur les registres de pathologie, des analyses biologiques des différents échantillons collectés, incluant des populations saines, y compris pédiatriques, comprenant l’étude du microbiote et de l’exposome, intégrant les outils d’intelligence artificielle particulièrement utiles à l’intégration des données à grande échelle. Ces études doivent être académiques, indépendantes de toutes pressions politiques ou économiques.